OBSTAKELS VAN TTP: Towards better diagnosis and treatment of Thrombotic Thrombocytopenic Purpura
Niet alleen de naam is een mondvol, maar ook de ziekte zelf laat zich niet makkelijk temmen. TTP is zonder behandeling fataal in 90% van de gevallen en zelfs met behandeling blijft het sterftecijfer 20%. Daarnaast zullen 40% van de patiënten hervallen. Voor vele patiënten blijft het dus niet bij een eenmalige acute episode, maar kan de ziekte gezien worden als een chronische aandoening met terugkerende (plotse) levensbedreigende aanvallen. Het uitstellen van de behandeling kan extreme gevolgen hebben, zoals ernstige orgaanschade, en kan zelfs leiden tot overlijden van de patiënt. Daarom vergt een acute TTP-aanval onmiddellijke hospitalisering.
Wat is de Oorzaak?
VWF (von Willebrand factor) is een essentieel molecule dat circuleert in ons bloed. Het werkt als een stukje kleefband dat bloedplaatjes bindt en zich vasthecht op plaatsen in het bloedvat waar er schade is. De binding van VWF, en dus ook bloedplaatjes, zorgt ervoor dat het bloed gestelpt wordt en geen bloed wegsijpelt naar de omliggende weefsels. Je kan het zien als een korstje aan de binnenkant van het bloedvat dat ervoor zorgt dat de wonde snel geneest.
VWF wordt echter geproduceerd als een heel lang stuk kleefband, terwijl er bij wondschade slechts een klein stukje nodig is. Deze lange stukken kleefband zijn gevaarlijk omdat ze spontaan kunnen openrollen en bloedplaatjes binden. Er wordt dan een bloedklonter gevormd, ook al is het bloedvat niet beschadigd. Om dit te voorkomen, werkt het eiwit ADAMTS13 als een schaar die de lange stukken VWF in kleine stukjes kleefband knipt. ADAMTS13 zorgt er dus voor dat er geen bloedklonters worden gevormd.
TTP wordt veroorzaakt door een tekort aan ADAMTS13. De oorzaak van dit tekort kan een mutatie in het ADAMTS13-gen zijn of de vorming van antilichamen tegen ADAMTS13.
Wat zijn de symptomen?
Het gevolg van een ADAMTS13-deficiëntie is dus de vorming van kleine Trombi. Deze trombi sluiten kleine bloedvaten af van bloed en bijgevolg zuurstof. Dit zuurstoftekort kan resulteren in orgaanfalen en uiteindelijk leiden tot de dood van de patiënt. TTP-patiënten vertonen vooral symptomen gelinkt aan hersenschade, hartfalen en problemen met het darm-maagstelsel, alsook de nieren.
Daarnaast worden TTP-patiënten geconfronteerd met Trombocytopenie. Dit betekent dat ze een tekort hebben aan vrije bloedplaatjes (trombocyten) in hun bloed.
Bijgevolg vertonen sommige TTP-patiënten paarse vlekken op de huid, die Purpura worden genoemd (Figuur 1). Bloedplaatjes helpen namelijk het bloed te stelpen wanneer een bloedvat beschadigd is. Wanneer er een tekort is aan bloedplaatjes, gebeurt dit niet en ontstaat er een lekkage van bloed uit de beschadigde bloedvaten.
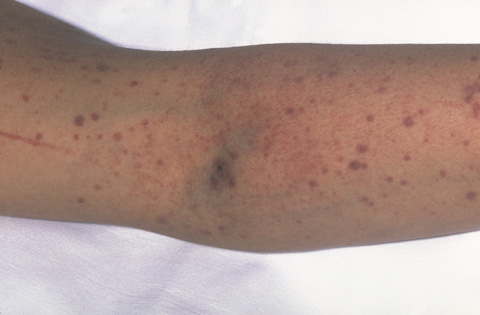
Figuur 1. Patiënt met purpura (grotere vlekken) en petechiën (rood-paarse stippen). Dit zijn kleine bloeduitstortingen in de huid. (Geraapleegd van National Heart, Lung, and Blood Institute; National Institutes of Health; U.S. Department of Health and Human Services. https://www.nhlbi.nih.gov/health-topics/thrombotic-thrombocytopenic-purpura.)
Als al dit gekend is… wat is dan het probleem?
Eerst en vooral: sommige zaken zijn nog niet gekend of niet helemaal duidelijk. In het onderzoek leidt het antwoord op de ene vraag vaak naar meerdere nieuwe vragen en dat is bij deze ziekte niet anders.
Het is belangrijk voor TTP dat er nog verder onderzoek wordt uitgevoerd naar:
- Factoren of manieren die het diagnoseproces kunnen vergemakkelijken. Momenteel is de diagnoseprocedure uiterst complex omdat de symptomen van TTP overlappen met die van andere ziektes. Bovendien kan TTP enkel met zekerheid gediagnosticeerd worden als er onderzoek wordt gedaan naar de activiteit van ADAMTS13, en het kan even wachten zijn op deze resultaten (vaak worden deze testen uitgevoerd in gespecialiseerde labo’s en niet in het ziekenhuis zelf). Kortom, deze complexiteit kan leiden tot een verkeerde diagnose en vertragingen in TTP-diagnose.
- Factoren die de ernst van een aanval kunnen verduidelijken en kunnen voorspellen wanneer een patiënt zal hervallen.
- Betere behandelingsmethodes, omdat TTP een chronische levensbedreigende ziekte is waarbij het sterftecijfer nog altijd 20% is.
Wat brengt deze studie bij?
Drie ADAMTS13-biomarkers die belangrijk zijn voor de diagnose en prognose van TTP-patiënten werden aangehaald in deze studie, namelijk:
- ADAMTS13 activiteit, wat nodig is voor het diagnosticeren van TTP. Er bestaan testen die kunnen meten “hoe actief ADAMTS13 is” en bepalen of deze functioneel is in de patiënt of niet. Echter, deze zijn duur en vragen veel vaardigheid, en worden daarom meestal niet in het ziekenhuis zelf uitgevoerd, waardoor kostbare tijd wordt verspild.
- anti-ADAMTS13 antilichamen, om een onderscheid te kunnen maken tussen patiënten waarvan de ADAMTS13-deficiëntie veroorzaakt wordt door antilichamen tegen ADAMTS13 en patiënten die een mutatie hebben in het ADAMTS13-gen. Dit onderscheid is belangrijk omdat deze patiënten verschillend behandeld worden.
- ADAMTS13 antigen, waarvan eerder onderzoek aangeeft dat dit wellicht een goede prognostische factor is en waarnaar verder onderzoek gewenst is.
In deze studie werd voor elk van deze markers een eenvoudige test ontwikkeld of verder uitgewerkt.
Ten slotte werd een klinisch relevante gentherapie voorgesteld voor patiënten met TTP, veroorzaakt door een mutatie in het ADAMTS13-gen. Bij gentherapie wordt genetisch materiaal ingebracht in de cellen, bij de voorgestelde methode is dat in de spiercellen. Dit genetisch materiaal zal in de cel gebruikt worden om een eiwit te produceren waarvan de patiënt (zonder de gentherapie) een tekort heeft, in dit geval ADAMTS13.
Om deze gentherapie te onderzoeken, werd genetisch materiaal gecreëerd, namelijk een DNA plasmide die murien (van de muis) ADAMTS13-DNA bevat. Er werd in vitro (in spiercellen die gekweekt worden in het labo) geverifieerd of dit plasmide zorgt voor de aanmaak van ADAMTS13. In de toekomst zal dit plasmide geïntroduceerd worden in spiercellen van muizen die een tekort hebben aan ADAMTS13. Zo wordt onderzocht of dit plasmide ook in vivo geproduceerd wordt en of deze gentherapie de muizen beschermt tegen TTP.









