Blindheid genezen met kanker
Kankercellen vermenigvuldigen zich snel en zijn soms onsterfelijk. Daardoor kunnen ze gebruikt worden om een ongelimiteerde hoeveelheid cellen te produceren voor de ontwikkeling van transplanteerbare weefsels.
Dat de beperkte hoeveelheid orgaandonoren voor lange wachtlijsten zorgt is algemeen gekend, maar ook wetenschappelijk onderzoek is sterk afhankelijk van humane cellen afkomstig van deze donoren. Decennia geleden heeft de wetenschap een oplossing bedacht voor dit tekort door “normale” cellen om te zetten in kankercellen. Kanker ontstaat door een opstapeling van mutaties in het DNA van een cel. Het is moeilijk om deze natuurlijke strategie op een gecontroleerde manier na te bootsen in het laboratorium. Daarom worden de cellen genetisch gemanipuleerd door speciale kankergenen in het DNA van de cellen te brengen. Dankzij deze genen krijgen de cellen eigenschappen die met kanker geassocieerd worden, zoals een snelle en onbeperkte vermenigvuldiging.
Het omzetten van “normale” cellen naar kankercellen in het laboratorium wordt ook wel immortalisatie genoemd. Op deze manier kan men van een kleine hoeveelheid cellen van een orgaandonor, oneindig veel cellen produceren en vervolgens gebruiken voor experimenten. Nagenoeg elk celtype in het menselijk lichaam (levercel, spiercel, witte bloedcel, …) kan geïmmortaliseerd worden. Maar deze geïmmortaliseerde cellen gebruiken om transplanteerbare weefsels te maken is gevaarlijk voor de patiënt… toch?
Knutselen met DNA
Geïmmortaliseerde cellen kunnen zich snel en ongelimiteerd vermenigvuldigen in het laboratorium. Maar doordat de omstandigheden in het lichaam minder optimaal zijn, leiden ze niet altijd tot de vorming van een tumor na transplantatie. Toch is de aanwezigheid van kankergenen een veiligheidsrisico, waardoor deze cellen niet geschikt zijn voor het ontwikkelen van transplanteerbare weefsels.
Als oplossing voor dit probleem kunnen de geïmmortaliseerde cellen opnieuw omgezet worden in “normale” cellen voordat ze in het lichaam terechtkomen. Dit gebeurt door de kankergenen, die eerder in het DNA van de cellen geplakt werden, weg te knippen. Hierdoor verliezen de geïmmortaliseerde cellen de eigenschap om zich snel en onbeperkt te vermenigvuldigen. Extra veiligheidsmechanismen verzekeren dat resterende cellen, waarbij het kankergen nog aanwezig is, verwijderd worden voordat ze in de patiënt terechtkomen.
Wat overblijft is een ongelimiteerde voorraad aan “normale” cellen. Doordat organen vaak uit verschillende celtypes bestaan, maar ook bloedvaten en zenuwen bevatten, zijn deze cellen op zichzelf onvoldoende om volledige organen na te maken zoals de lever of de longen. Wel kunnen de verkregen cellen gebruikt worden om eenvoudige weefsels te ontwikkelen die bestaan uit één celtype en waarin bloedvaten en zenuwen overbodig zijn. Een voorbeeld van zo’n weefsel is het endotheel. Het bevindt zich aan de achterzijde van het hoornvlies, de doorzichtige laag aan de voorzijde van het oog (Figuur 1).
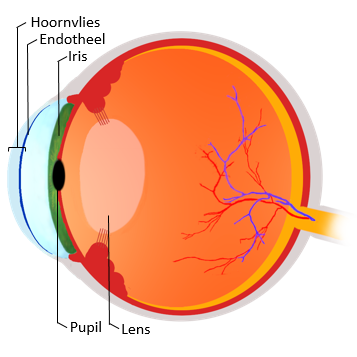
Figuur 1: Schematische voorstelling van het oog.
Ik zie, ik zie wat jij niet ziet
Vertroebelingen van het hoornvlies hebben een enorme invloed op onze samenleving. De visuele beperking die hiermee gepaard gaat, tast de zelfstandigheid van de patiënten aan. Ook de kosten voor de maatschappij kunnen stevig oplopen. Wereldwijd wachten 13 miljoen mensen op een hoornvliestransplantatie om van hun visuele beperking af te raken. Meer dan de helft van deze patiënten kan geholpen worden door enkel het hoornvlies endotheel te vervangen.
Ook nu al transplanteert men alleen het endotheel in plaats van het volledige hoornvlies indien dit mogelijk is. Dit heeft als voordeel dat de patiënt sneller herstelt na de operatie. Voor een transplantatie van het endotheel is de patiënt op dit moment nog afhankelijk van een orgaandonor, maar de geïmmortaliseerde cellen kunnen hier verandering in brengen.
Door de endotheelcellen van het hoornvlies van één orgaandonor te immortaliseren, kunnen grote hoeveelheden van dit celtype aangemaakt worden. Eenmaal genoeg cellen zijn verkregen, worden de kankergenen weggeknipt. Wat overblijft zijn “normale” endotheelcellen zonder de eigenschappen van een kankercel. Deze kunnen dan gebruikt worden om patiënten te behandelen die op de wachtlijst staan voor een hoornvliestransplantatie. Normaal is het hoornvlies van één donor geschikt voor de behandeling van één patiënt. Maar met behulp van bovenstaande techniek kan men met één donor, duizenden patiënten van een transplantaat voorzien.
Rome is niet op een dag gebouwd
Ondertussen zijn de experimenten om de kankergenen in het DNA te plakken bijna beëindigd. Hiervoor werd gebruik gemaakt van virussen die van nature expert zijn in het knippen en plakken van DNA. Om na te gaan hoe effectief virussen hierin zijn, hebben we het GFP (groen fluorescerend proteïne) gen in het DNA van de cellen geplakt in plaats van een kankergen. Zoals de naam het al zegt, krijgen de cellen die het GFP gen bevatten een groen fluorescerende kleur. Op deze manier kan eenvoudig worden nagegaan hoeveel cellen het GFP gen bevatten. Hoe meer groen fluorescerende cellen, hoe effectiever het virus. Daarnaast zijn er ook nog andere factoren die een belangrijke rol spelen, zoals de hoeveelheid van en de blootstellingstijd aan deze virussen. Bij het gebruik van grote hoeveelheden virussen bevatten tot 100% van de cellen het GFP gen. In Figuur 2 is een foto te zien waarbij een lagere hoeveelheid virussen gebruikt werd en daardoor maar 60-70% van de cellen het GFP gen in hun DNA hebben opgenomen. Als we het experiment herhalen onder dezelfde omstandigheden, maar met een kankergen in plaats van het GFP gen, dan weten we dat ook hier 60-70% van de cellen het gen zal bevatten.
Het volledige project vraagt natuurlijk jaren van onderzoek en optimalisatie. Voorlopig ziet het er dus naar uit dat we afhankelijk zullen blijven van orgaandonoren om patiënten met een vertroebeling van het hoornvlies vooruit te helpen. Wel zijn we ondertussen een stap dichter gekomen om met kanker blindheid te genezen.
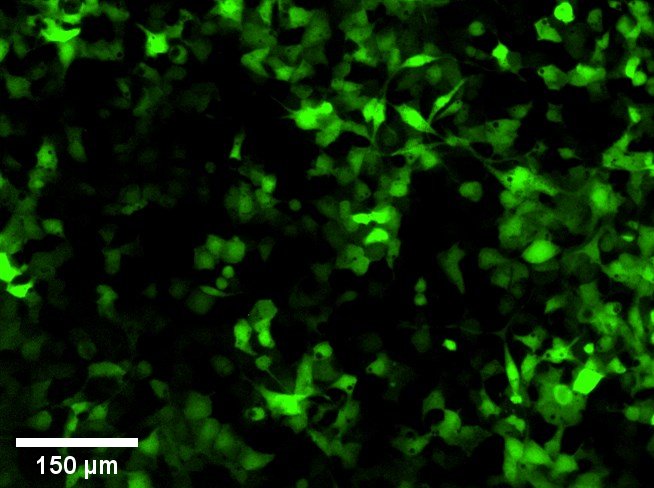
Figuur 2: Foto van genetisch gemanipuleerde hoornvlies endotheelcellen gemaakt met behulp van een microscoop. De cellen hebben een groen fluorescerende kleur dankzij het GFP gen dat met behulp van virussen in hun DNA werd gebracht.









