Bacteriën als sluitstuk van onze stikstofkringloop?
2 500 000 TJ, ofwel 13 keer de jaarlijkse capaciteit van het Belgisch kernenergiepark. Zo veel energie wordt er elk jaar verbruikt door de ammoniakindustrie. Nochtans is ammoniak een onmisbare grondstof voor de kunstmest die u in uw dagelijkse portie voedsel voorziet. Kan dit duurzamer?
Stikstoffixatie: de stap te veel?
Ammoniak wordt vandaag geproduceerd via ‘stikstoffixatie’, ofwel het vastzetten van stikstofgas in stoffen die gewassen gemakkelijker kunnen opnemen. Het huidige productieproces gebruikt hiervoor waterstofgas verkregen uit aardgas en stikstofgas uit lucht. Daardoor neemt het wel 5 % van de globale aardgasvraag en 1 % van de totale CO2-emissies voor zijn rekening. Deze gefixeerde stikstof belandt uiteindelijk in ons afval. Nu, u zou kunnen zeggen dat dit een noodzakelijk kwaad is, maar tijdens de afvalverwerking wordt een deel van deze stikstof terug in stikstofgas ‘gedefixeerd’. Zonde van de energie die verbruikt is tijdens de productie.
Wat als we gefixeerde stikstof konden recycleren en zo het fixatieproces overslaan? Mijn thesis bouwt verder op een idee dat bacteriën inschakelt om afvalstikstof terug om te zetten in ammoniak en zo de menselijke stikstofcyclus rond te maken. De stikstofcomponenten in ons afval zijn vooral proteïnes. Bacteriën zoals de Bacillus subtilis kunnen deze grote molecules afbreken tot hun afzonderlijke bouwstenen, de aminozuren. De microbe hergebruikt deze dan om nieuwe proteïnes en cellen aan te maken of breekt ze volledig af voor zijn eigen energievoorziening, wat CO2 en ammoniak oplevert.
Vechten tegen Darwin
Jammer genoeg is er een stevig obstakel. De evolutietheorie van Darwin, u hoeft daar waarschijnlijk geen inleiding bij. Een micro-organisme zoals de Bacillus subtilis tracht de soort te laten overleven o.a. door zo veel mogelijk cellen aan te maken, want dan zijn de kansen groter dat er minstens één het overleeft. Alle twintig types aminozuren zijn daarvoor nodig, maar vaak moet het ene type deels in het andere worden omgezet, wat dikwijls ammoniak verbruikt. Het eventuele overschotje aan ammoniak is voor ons.
Het metabolisme is dus cruciaal. Dat is het ensemble aan chemische reacties dat een organisme uitvoert. Om ammoniak over te houden, moet het verbruik voor de opbouw van cellen beperkt worden en/of de ammoniakproducerende reacties versterkt. Elke reactie heeft zijn eigen biologische katalysator, het enzym, waarvan de bouwplannen in het bijhorende gen in het DNA vervat zijn. De reactiesnelheid kan gecontroleerd worden o.a. door de expressie van dat gen te regelen. De centrale vraag in deze thesis is daarom in welke reacties - en bijgevolg genen – er moet ingegrepen worden om zo veel mogelijk ammoniak te verkrijgen.
Metabolische netwerkmodellen: de computer als loodgieter
Ik vond een mogelijke oplossing in het simuleren van het metabolisme via een zogenaamd ‘metabolisch netwerkmodel’. Door opeenvolgende reacties aan elkaar te linken in een diagram, is het mogelijk om het volledige metabolisme voor te stellen als één groot netwerk waarvan elke lijn afzonderlijk een reactie met zijn enzym voorstelt. Het aantal lijnen kan gemakkelijk oplopen tot boven de duizend. Vergelijk het met een groot waterleidingnetwerk waarbij elke waterstroom een reactie voorstelt en waar er op elke afzonderlijke buis een kraantje zit om de stroomsnelheid te regelen. Het is dus niet verwonderlijk dat alle reactiesnelheden in dit netwerk opmeten een lastig karwei is.
U voelt de bui al hangen: het probleem is tweeledig, zoals Figuur 1 illustreert. Eerst moet er een manier gevonden worden om alle reactiesnelheden in het netwerk te bepalen. Pas daarna kan het netwerk zelf onder handen genomen worden. Gelukkig kan de wiskunde hulp bieden bij het eerste probleem door een beredeneerde gok te doen. Het is mogelijk met een computer er een optimalisatiealgoritme op los te laten. Daarbij definieer je enerzijds het ‘objectief’, dat wat geoptimaliseerd wordt, en anderzijds beperkingen om de zoekruimte af te bakenen. Uit een vorige paragraaf weet u dat een microbe zo veel mogelijk cellen tracht aan te maken. Klinkt dat niet als een objectief? Verder zijn er nog allerlei beperkingen zoals de snelheid waarmee de bacterie aminozuren kan verwerken, de hoeveelheid aanwezige enzymen... Samenvattend, dit optimalisatiealgoritme schat welk metabolisme het micro-organisme nastreeft met de beschikbare middelen in zijn overlevingsstrijd. Het plaatst zo als het ware een wijzerplaatje op elke leiding van het waternetwerk.
Nu kunnen we doelgericht aan het metabolisme zelf sleutelen. De vraag hierbij is aan welke figuurlijke kraantjes te draaien opdat de ammoniakstroom zo groot mogelijk wordt. Via de methode hierboven wordt telkens het effect van een ingreep bepaald. Twee nieuwe algoritmes testen zo verschillende combinaties uit, elk volgens hun eigen strategie. Het eerste zoekt met brute rekenkracht één ingreep die de grootste verbetering teweeg brengt, zet deze vast en herhaalt dit voor elke nieuwe versie van het netwerk. Het andere simuleert biologische evolutie, waarbij een hogere ammoniakproductie als superieur wordt gezien. Door een samenspel van mutaties en paringsvoorkeuren onthult het de beste genetische veranderingen.
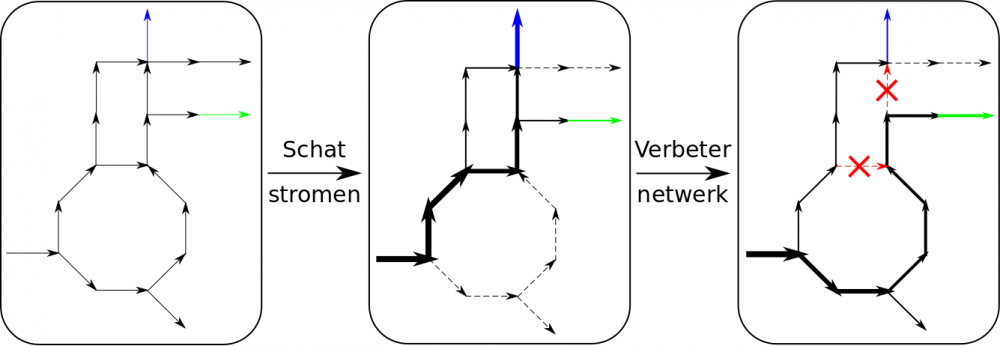
Figuur 1: Fictief netwerk met illustratie van de optimalisatiemethode. De cel optimaliseert spontaan de celaanmaak (blauw), maar door ingrepen wordt de cel gedwongen daarbij zo veel mogelijk gewenst product (groen) te maken. De pijldikte is evenredig met de stroomsnelheid.
Goed begonnen...
Ondanks hun verschillende aanpak wezen beide algoritmes in dezelfde richting. Een combinatie van twee types ingrepen kan de ammoniakproductie per cel tot wel 16 % doen stijgen t.o.v. het ongewijzigde metabolisme. Het ene type produceert extra ammoniak door meer stikstofrijke aminozuren af te breken. Het andere verlaagt het ammoniakverbruik door de aanmaak van nieuwe cellen te beperken.
Als aanvullend onderzoek werd getest of het netwerkmodel experimentele productiesnelheden kan voorspellen. Het bleek dat enkele nieuwe reacties aan het netwerk dienden toegevoegd te worden omdat er stoffen werden geproduceerd die niet in het model aanwezig waren. Verdere verfijning blijft ook nodig. Dat betekent dat we nog enigszins een slag om de arm moeten houden met de optimalisatieresultaten, maar ze wijzen toch al in een duidelijke richting.
De menselijke stikstofcyclus sluiten m.b.v. microben zal zeker nog veel voeten in de aarde hebben, maar de vooruitgang van de biotechnologie houdt ook hier alvast potentieel in. Misschien kan het zo zelfs bijdragen aan een nieuwe generatie afvalverwerking en ons energie besparen.









